Hemimastikatorischer Spasmus
Zusammenfassung
Dieses Kapitel und die Reihe von Unterabschnitten werden hauptsächlich dem klinischen Fall unserer armen Patientin Mary Poppins gewidmet sein, die 10 Jahre warten musste, um eine genaue und detaillierte Diagnose von 'Hemimasticatory Spasm' zu erhalten, wobei sie zwischen den beiden Schwerpunkten der zahnärztlichen und neurologischen Kontexte stand. Neben allen anderen medizinischen Fachgebieten, die auf dem diagnostischen Weg begegnet sind, wie Dermatologie, die 'Morfea' diagnostiziert hat. Es wäre zu voreilig, dieses klinische Ereignis abzulehnen, indem man die Diagnose des Hemimasticatory Spasms bestätigt, ohne den Grund für die diagnostische Verzögerung zu verstehen, und noch weniger, die Elemente zu vernachlässigen, die dem Kliniker helfen könnten, eine Diagnose schneller und genauer zu formulieren. In diesem Abschnitt von Masticationpedia möchten wir daher damit beginnen, die Grundlagen für eine formalere Sprache in der medizinischen Diagnostik vom mathematischen Typ und nicht vom klassischen Modell aufzubauen, bei dem Ambiguität und Unklarheit den diagnostischen Prozess manchmal erschweren können und zu gefährlichen jahrzehntelangen Verzögerungen für das Leben des Menschen führen können. Wir werden daher einige Inhalte aufgreifen, die bereits im Abschnitt 'Einleitung' vorgeschlagen wurden, und sie praktisch und klinisch unerlässlich für die Diagnose unserer Patientin Mary Poppins machen.
Einführung
Bevor wir uns in die Kernfrage der Diskussion über die Pathologie unserer Patientin Mary Poppins begeben, scheint es wichtig, sich auf einige Aspekte eines neuromotorischen Typs zu konzentrieren, insbesondere auf einen 'Hemimasticatory Spasm', um den Entschlüsselungsprozess des Signals zu bestimmen.
Zunächst einmal ist es nicht so komplex, eine Diagnose eines 'Hemimasticatory Spasm' zu stellen, aber es ist schwieriger, eine differenzialdiagnostische Abgrenzung zwischen einem 'Hemifacial Spasm' und der Art der Erkrankung zur Ausrichtung der Therapie vorzunehmen.
Wir sollten zunächst induzierte Bewegungsstörungen in Betracht ziehen, die als unfreiwillige oder abnormale Bewegungen definiert werden, die durch Trauma der Schädel-oder peripheren Nerven oder Wurzeln ausgelöst werden.[1] In diesem Zusammenhang sollten unfreiwillige Bewegungen einschließlich Spasmen sowie Pathologien des Zentralnervensystems sowie des peripheren Nervensystems berücksichtigt werden. In einer Studie von Seung Hwan Lee et al.[2] wurden zwei Vestibularschwannome, fünf Meningeome und zwei Epidermoidtumore einbezogen. Ein Hemifacialspasmus trat bei acht Patienten auf derselben Seite der Läsion auf, während er bei nur einem Patienten auf der gegenüberliegenden Seite der Läsion auftrat. Hinsichtlich der Pathogenese von Hemifacialspasmen waren bei sechs Patienten die Blutgefäße beteiligt, der Tumor hatte bei einem Patienten die Auskleidung des Gesichtsnervs betroffen, ein hypervaskulärer Tumor hatte den Gesichtsnerv ohne Schädigung der Blutgefäße bei einem Patienten komprimiert, und ein riesiger Tumor, der den Hirnstamm komprimierte, hatte somit die Beteiligung des kontralateralen Gesichtsnervs bei einem Patienten verursacht. Der Hemifacialspasmus löste sich bei sieben Patienten auf, während er sich bei zwei Patienten mit einem Vestibularschwannom und einem Epidermoidtumor vorübergehend verbesserte und dann nach einem Monat wieder auftrat.
Daher sollten lokale Ursachen, einschließlich zentraler Ursachen, die zu Gesichts- und/oder Kieferspasmen führen können, berücksichtigt werden, wie zum Beispiel Fälle von Vestibularschwannom und Epidermoidtumor.
Vestibuläres und Trigeminus-Schwannom
Sekundärer Hemifacialspasmus aufgrund eines Vestibularschwannoms ist sehr selten. Die Studie von S. Peker et al.[3] war der erste berichtete Fall eines Hemifacialspasmus, der auf Gamma-Knife-Radiochirurgie bei einem Patienten mit einem intrakanalikulären Vestibularschwannom ansprach. Sowohl die Spasmusauflösung als auch die Kontrolle des Tumorwachstums wurden mit einer einzigen Sitzung der Gamma-Knife-Radiochirurgie erreicht. Der 49-jährige männliche Patient hatte eine 6-monatige Anamnese mit einseitigem Hörverlust und Hemifacialspasmus. Die MRT-Untersuchung ergab ein intrakanalikuläres Vestibularschwannom. Der Patient wurde mit Radiochirurgie behandelt und erhielt 13 Gy an der 50% Isodosenlinie. Eine Kontrolle des Tumorwachstums wurde erreicht und es gab keine Veränderung des Tumorvolumens bei der letzten Nachuntersuchung nach 22 Monaten. Der Hemifacialspasmus war nach einem Jahr vollständig aufgelöst. Die chirurgische Entfernung der vermutlich verursachenden Raumforderung wurde als einzige Behandlung bei sekundärem Hemifacialspasmus beschrieben.
Die MRT ist die Bildgebungsmodalität der Wahl und ist in der geeigneten klinischen Situation in der Regel diagnostisch aussagekräftig. Die dünn geschnittenen T2-gewichteten 3D-CISS-Axialsequenzen sind wichtig für die korrekte Bewertung des zisternalen Segments des Nervs. Sie sind normalerweise hypointens in T1, hyperintens in T2 mit Kontrastmittelanreicherung nach Gadolinium. Aber es sollte uns nicht überraschen, wenn Fälle wie der von Brandon Emilio Bertot et al.[4] auftreten, in dem ein klinischer Fall eines 16-jährigen Jungen mit einer atypischen Inzidenz eines großen Trigeminus-Schwannoms mit schmerzloser Malokklusion und einseitiger Kaukraftschwäche präsentiert wurde. Dieser Fall ist nach unserem Kenntnisstand der erste dokumentierte Fall, bei dem ein Trigeminus-Schwannom eine echte Malokklusion mit Masseterschwäche verursachte, und ist der 19. dokumentierte Fall einer einseitigen Trigeminus-Motorneuropathie verschiedener Ätiologie. Aus einer Studie von Ajay Agarwal[5] geht jedoch hervor, dass intrakranielle Trigeminus-Schwannome seltene Tumoren sind. Die Patienten präsentieren sich in der Regel mit Symptomen einer Funktionsstörung des Trigeminusnervs, wobei das häufigste Symptom Gesichtsschmerzen sind.
Multiple Sklerose und Trigeminusreflexe
Wir müssen eine weitere Prämisse bezüglich der axonalen Demyelinisierung bei Multipler Sklerose machen. Eine Studie von Joanna Kamińska et al.[6] zeigten, dass Multiple Sklerose (MS) eine chronisch entzündliche und demyelinisierende Erkrankung autoimmunen Ursprungs ist. Zu den Hauptverursachern der Entstehung von MS zählen exogene, umweltbedingte und genetische Faktoren. MS ist durch eine multifokale und zeitlich verstreute Schädigung des Zentralnervensystems (ZNS) gekennzeichnet, die zu axonalen Schäden führt. Unter den klinischen Verläufen der MS können wir zwischen schubförmig-remittierender Multipler Sklerose (RRMS), sekundär progressiver Multipler Sklerose (SPSM), primär progressiver Multipler Sklerose (PPMS) und schubförmig progressiver Multipler Sklerose (RPMS) unterscheiden. Abhängig von der Schwere der Anzeichen und Symptome kann MS als gutartige MS oder als bösartige MS beschrieben werden. Die Diagnose von MS basiert auf den Diagnosekriterien von McDonald's, die die klinische Manifestation mit den charakteristischen Läsionen verknüpfen, die durch Magnetresonanztomographie (MRT) nachgewiesen werden können. durch Analyse der Zerebrospinalflüssigkeit (CSF) und visuell evozierter Potenziale. Es sollte betont werden, dass diese Krankheit trotz enormer Fortschritte bei MS und der Verfügbarkeit verschiedener Diagnosemethoden immer noch eine diagnostische Herausforderung darstellt. Dies kann auf die Tatsache zurückzuführen sein, dass MS einen anderen klinischen Verlauf hat und ein einziger Test mit angemessener diagnostischer Sensitivität und Spezifität für eine schnelle und genaue Diagnose fehlt. Gerade in Bezug auf diese letzte Beobachtung müssen wir auf weitere wichtige Daten hinweisen, die aus einer Studie von S. K. Yates und W. F. Brown[7] hervorgegangen sind, in der wir lesen, dass der Kieferruck des Kaumuskels bei allen Kontrollpersonen vorhanden ist, bei Patienten mit definierter Sklerose jedoch häufig fehlt mehrfach (SM). Bei einigen MS-Patienten war die Latenzzeit verlängert. Anomalien des Kieferrucks sind jedoch seltener als Blinzelreflexreaktionen auf die Stimulation des supraorbitalen Nervs. Es gab jedoch Patienten, bei denen der Blinzelreflex normal war, die Kieferruckreaktionen jedoch abnormal waren.
Die letztgenannte Beobachtung legt nahe, dass der Kieferruck gelegentlich bei der Erkennung von Hirnstammläsionen bei MS nützlich sein kann.
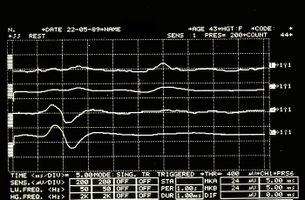
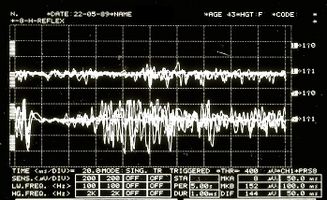
Aber an diesem Punkt wird der Zweifel Wirklichkeit: Was sollen wir dann von den Anomalien der Trigeminusreflexe halten, die bei unseren Mary Poppins auftraten? Könnte es sein, dass wir es mit einer Form von „Multiple Sklerose“ zu tun haben? Wie unterscheiden wir den Ort einer Demyenisierung, ob zentral oder peripher? (Abbildung 3 und 4)
Pleomorphes Adenom
Das pleomorphe Adenom ist eine häufige gutartige Neubildung der Speicheldrüsen, die durch eine neoplastische Proliferation von Epithelzellen (Duktalzellen) zusammen mit Myoepithelkomponenten mit bösartigem Potenzial gekennzeichnet ist. Es ist die häufigste Art von Speicheldrüsentumor und der häufigste Tumor der Ohrspeicheldrüse. Der Name leitet sich vom architektonischen Pleomorphismus (veränderliches Erscheinungsbild) ab, der unter einem optischen Mikroskop beobachtet wird. Er wird auch als „Mischtumor vom Speicheldrüsentyp“ bezeichnet, was sich auf seinen dualen Ursprung aus epithelialen und myoepithelialen Elementen im Gegensatz zu seinem pleomorphen Erscheinungsbild bezieht.
Die Diagnose von Speicheldrüsentumoren erfolgt sowohl durch Gewebeproben als auch durch Röntgenuntersuchungen. Zu den Gewebeprobenentnahmeverfahren gehören Feinnadelaspiration (FNA) und Kernnadelbiopsie (größere Nadel als FNA). Beide Eingriffe können ambulant durchgeführt werden. Zu den diagnostischen Bildgebungsverfahren für Speicheldrüsentumoren gehören Ultraschall, Computertomographie (CT) und Magnetresonanztomographie (MRT). Die CT ermöglicht eine direkte beidseitige Visualisierung des Speicheldrüsentumors und liefert Informationen über die Gesamtgröße und die Gewebeinvasion. Die CT eignet sich hervorragend zum Nachweis einer Knocheninvasion. Die MRT bietet im Vergleich zur alleinigen CT eine bessere Abgrenzung von Weichgeweben wie perineuralen Invasionen, wie auch von Mehmet Koyuncu et al.[8]

Diese letzte Beobachtung ist sehr wichtig, da eine Invasion des Tumors des Nervengewebes in der Fossa infratemporalis nicht ausgeschlossen werden kann und gerade wegen der Komplexität der Erkrankung über eine Arbeit von Rosalie A Machado et al.[9] berichtet wird, die in untersucht werden kann ausführlich im Unterkapitel von Masticationpedia „Intermittent facial spasms as the presenting sign of a recurrent pleomorphic adenoma“, in dem die Autoren bestätigen, dass bisher nicht über die Entwicklung von Gesichtsspasmen bei Ohrspeicheldrüsenneoplasien berichtet wurde. Die häufigsten Ursachen für hemifazialen Spasmus sind Gefäßkompression des Gesichtsnervs ipsilateral zum Kleinhirnbrückenwinkel (definiert als primär oder idiopathisch) (62 %), erblich (2 %), sekundär zu Bell-Lähmung oder Gesichtsnervenverletzung (17 %) und Imitatoren hemifazialer Spasmen (psychogen, Tics, Dystonie, Myoklonus, Myokymie, Myorrhythmie und hemimastikatorischer Spasmus) (17 %).
Sklerodermie
Tiago Nardi Amaral et al.[10] beschrieben die klinischen Merkmale, die Neurobildgebung und die Behandlung der neurologischen Beteiligung bei systemischer Sklerose (SSc) und lokalisierter Sklerodermie (LS) anhand einer systematischen Übersicht
Die Autoren führten eine Literaturrecherche in PubMed unter Verwendung der folgenden MeSH-Begriffe durch: Sklerodermie, systemische Sklerose, lokalisierte Sklerodermie, lokalisierte Sklerodermie „en coup de sabre“, Parry-Romberg-Syndrom, kognitive Beeinträchtigung, Gedächtnis, Anfälle, Epilepsie, Kopfschmerzen, Depression, Angstzustände, Stimmungsstörungen, Center for Epidemiological Studies in Depression (CES-D), SF-36, Beck Depression Inventory (BDI), Beck Anxiety Inventory (BAI), Patient Health Questionnaire-9 (PHQ-9), Neuropsychiatrie, Psychose, neurologische Beteiligung, Neuropathie, periphere Nerven, Hirnnerven, Karpaltunnelsyndrom, Ulnareinklemmung, Tarsaltunnelsyndrom, Mononeuropathie, Polyneuropathie, Radikulopathie, Myelopathie, autonomes Nervensystem, Nervensystem, Elektroenzephalographie (EEG), Elektromyographie (EMG), Magnetresonanztomographie (MRT) und Magnetresonanzangiographie (MRA). Patienten mit anderen Bindegewebserkrankungen, die für eine Beteiligung des Nervensystems verantwortlich sind, wurden von den Analysen ausgeschlossen.
Insgesamt wurden 182 Fallberichte/Studien zum Thema SSc und 50 berichtende LS identifiziert. Die Gesamtzahl der Patienten mit SSc betrug 9.506, während Daten zu 224 Patienten mit LS vorlagen. Bei LS überwogen Krämpfe (41,58 %) und Kopfschmerzen (18,81 %). Es wurden jedoch verschiedene Hirnnervenbeteiligungen und Hemiparesen beschrieben. Die Beteiligung des Zentralnervensystems bei SSc war durch Kopfschmerzen (23,73 %), Krampfanfälle (13,56 %) und kognitive Beeinträchtigung (8,47 %) gekennzeichnet. Depressionen und Angstzustände wurden häufig beobachtet (73,15 % bzw. 23,95 %). Myopathie (51,8 %), Trigeminusneuropathie (16,52 %), periphere sensomotorische Polyneuropathie (14,25 %) und Karpaltunnelsyndrom (6,56 %) waren die häufigsten Beteiligungen des peripheren Nervensystems bei SSc. Es wurde regelmäßig eine autonome Neuropathie des Herz-Kreislauf- und Magen-Darm-Systems beschrieben. Die Behandlung einer Beteiligung des Nervensystems variierte jedoch von Fall zu Fall. In schwereren Fällen wurden jedoch meist Kortikosteroide und Cyclophosphamid verschrieben.
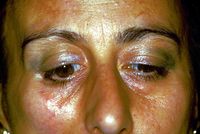
Aber das ist noch nicht alles, denn bei unserer armen Patientin Mary Poppins wurden einige Varianten der Sklerodermie wie Morphea diagnostiziert, die unter anderem nicht positiv auf eine Kortisontherapie reagierte.
Morphea
Morphea ist eine Form der Sklerodermie, bei der isolierte Flecken verhärteter Haut im Gesicht, an Händen und Füßen oder anderswo am Körper auftreten, ohne dass innere Organe betroffen sind. Morphea stellt sich am häufigsten als Makulae oder Plaque mit einem Durchmesser von einigen Zentimetern dar, kann aber auch als Band oder in guttierten Läsionen oder Knötchen auftreten.[11] Morphea ist eine Verdickung und Verhärtung der Haut und des Unterhautgewebes aufgrund übermäßiger Kollagenablagerung. Morphea umfasst spezifische Erkrankungen, die von sehr kleinen Plaques, die nur die Haut betreffen, bis hin zu weit verbreiteten Erkrankungen reichen, die zu funktionellen und kosmetischen Deformationen führen. Morphea unterscheidet sich von der systemischen Sklerose durch die vermutlich fehlende Beteiligung innerer Organe.[12]
Leider ist der Weg immer noch schwierig, da die lange Reihe von Varianten eine Form des Morphea-induzierten hemimastikatorischen Spasmus, wie er auch von H. J. Kim et al.[13] beschrieben wurde, nicht ausschließt. Darin wird behauptet, dass auf der Grundlage trigeminaler klinischer und elektrophysiologischer Befunde wie dem Blinzelreflex, dem Kieferruck und der masseteriellen Ruheperiode eine fokale Demyelinisierung der motorischen Äste des Trigeminusnervs aufgrund tiefer Gewebeveränderungen als Ursache vermutet wird von elektrischen Aktivitäten, abnormale erregende Bewegungen, die zu unwillkürlichen Kaubewegungen und Krämpfen führen.
Die letztere Behauptung weist auf eine Beteiligung normaler und ephaptischer erregender elektrischer Aktivitäten hin.
Abschluss
Bevor wir die Wege besprechen, die zur Diagnose des „hemimasticatorischen Spasmus“ unserer armen Patientin Mary Poppins geführt haben, sollten wir voraussehen, dass es sich bei dem verschlüsselten Code, den wir als Kommunikationsphänomen identifizieren wollten, um die „ephaptische Übertragung“ handelt, ein sehr wichtiges und komplexes Phänomen hervorzurufen, erfordert aber vor allem eine Beschreibung der elektrischen Übertragung zwischen Neuronen.
Elektrische Signale sind ein Schlüsselmerkmal des Nervensystems und verleihen ihm die Fähigkeit, schnell auf Veränderungen in der Umgebung zu reagieren. Obwohl die synaptische Kommunikation zwischen Nervenzellen in erster Linie als chemisch vermittelt wahrgenommen wird, kommt es auch zu elektrischen synaptischen Interaktionen. Für die elektrische Kommunikation zwischen Neuronen sind zwei unterschiedliche Strategien verantwortlich. Einer davon ist die Folge von interzellulären Pfaden mit geringem Widerstand, sogenannten „Gap Junctions“, für die Diffusion elektrischer Ströme zwischen dem Inneren zweier Zellen. Die zweite tritt bei fehlenden Zell-Zell-Kontakten auf und ist eine Folge der extrazellulären elektrischen Felder, die durch die elektrische Aktivität von Neuronen erzeugt werden. In dem diesem grundlegenden Thema gewidmeten Kapitel werden aktuelle Vorstellungen zur elektrischen Übertragung aus historischer Perspektive diskutiert und die Beiträge der beiden verschiedenen Formen der elektrischen Kommunikation zur Gehirnfunktion verglichen.(Two Forms of Electrical Transmission Between Neurons*)
- ↑ Joseph Jankovic. Peripherally induced movement disorders Neurol Clin. 2009 Aug;27(3):821-32, vii, doi: 10.1016/j.ncl.2009.04.005.
- ↑ Seung Hwan Lee 1, Bong Arm Rhee, Seok Keun Choi, Jun Seok Koh, Young Jin Lim. Cerebellopontine angle tumors causing hemifacial spasm: types, incidence, and mechanism in nine reported cases and literature review. Acta Neurochir (Wien) 2010 Nov;152(11):1901-8. doi: 10.1007/s00701-010-0796-1.Epub 2010 Sep 16.
- ↑ S Peker, K Ozduman, T Kiliç, M N Pamir. Relief of hemifacial spasm after radiosurgery for intracanalicular vestibular schwannoma. Minim Invasive Neurosurg. 2004 Aug;47(4):235-7. doi: 10.1055/s-2004-818485.
- ↑ Brandon Emilio Bertot, Melissa Lo Presti, Katie Stormes, Jeffrey S Raskin, Andrew Jea, Daniel Chelius, Sandi Lam. Trigeminal schwannoma presenting with malocclusion: A case report and review of the literature.Surg Neurol Int. 2020 Aug 8;11:230. doi: 10.25259/SNI_482_2019.eCollection 2020.
- ↑ Ajay Agarwal. Intracranial trigeminal schwannoma Ajay Agarwal. Neuroradiol J.2015 Feb;28(1):36-41. doi: 10.15274/NRJ-2014-10117.
- ↑ Joanna Kamińska, Olga M Koper, Kinga Piechal, Halina Kemona . Multiple sclerosis - etiology and diagnostic potential.Postepy Hig Med Dosw. 2017 Jun 30;71(0):551-563.doi: 10.5604/01.3001.0010.3836.
- ↑ S K Yates, W F Brown. The human jaw jerk: electrophysiologic methods to measure the latency, normal values, and changes in multiple sclerosis.Neurology. 1981 May;31(5):632-4.doi: 10.1212/wnl.31.5.632.
- ↑ Mehmet Koyuncu, Teoman Seşen, Hüseyin Akan, Ahmet A Ismailoglu, Yücel Tanyeri, Atilla Tekat, Recep Unal, Lütfi Incesu. Comparison of computed tomography and magnetic resonance imaging in the diagnosis of parotid tumors.Otolaryngol Head Neck Surg. 2003 Dec;129(6):726-32.doi: 10.1016/j.otohns.2003.07.009.
- ↑ . 2017 Feb 10;8(1):86-90. doi: 10.5306/wjco.v8.i1.86. Rosalie A Machado, Sami P Moubayed, Azita Khorsandi, Juan C Hernandez-Prera, Mark L Urken. Intermittent facial spasms as the presenting sign of a recurrent pleomorphic adenoma. World J Clin Oncol. 2017 Feb 10;8(1):86-90. doi: 10.5306/wjco.v8.i1.86.
- ↑ Tiago Nardi Amaral, Fernando Augusto Peres, Aline Tamires Lapa, João Francisco Marques-Neto, Simone Appenzeller. Neurologic involvement in scleroderma: a systematic review Semin Arthritis Rheum. 2013 Dec;43(3):335-47. doi: 10.1016/ j.semarthrit. 2013.05.002. Epub 2013 Jul 1.
- ↑ James, William; Berger, Timothy; Elston, Dirk (2005). Andrews' Diseases of the Skin: Clinical Dermatology. (10th ed.). Saunders. Page 171. ISBN 0-7216-2921-0.
- ↑ James, William; Berger, Timothy; Elston, Dirk (2005). Andrews' Diseases of the Skin: Clinical Dermatology. (10th ed.). Saunders. Page 171. ISBN 0-7216-2921-0.
- ↑ H J Kim, B S Jeon, K W Lee. Hemimasticatory spasm associated with localized scleroderma and facial hemiatrophy.Arch Neurol. 2000 Apr;57(4):576-80. doi: 10.1001/archneur.57.4.576.