Spasmo emimasticatorio
Spasmo emimasticatorio
Riassunto
Questo capitolo e la serie di sub capitoli saranno dedicati principalmente al caso clinico della nostra povera paziente Mary Poppins che ha dovuto aspettare ben 10 anni per avere una diagnosi certa e dettagliata di Spasmo Emimasticatorio trovandosi tra due fuochi quello del contesto odontoiatrico, e quello neurologico oltre tutte le altre branche della medicina incontrate nel percorso clinico tipo la dermatologia che fece diagnosi di morfema. Sarebbe troppo sbrigativo liquidare questo evento confermando la diagnosi di Spasmo Emimasticatorio senza comprendere il perchè del ritardo diagnostico e tantomeno trascurare gli elementi che potrebbe aiutare il clinico a formulare una diagnosi rapida ed dettagliata. In questa sezione di Masticationpedia, perciò, vorremmo iniziare a gettare le basi per un linguaggio più formale nella diagnostica medica del tipo matematico e non del classico modello in cui l'ambiguità e la vaghezza possono complicare l'iter diagnostico con ritardi decennali a volte pericolosi per la vita dell'essere umano. Riprenderemo, dunque, alcuni contenuti già proposti nella sezione 'Introduction' e li renderemo pratici e clinicamente essenziali nella diagnosi della nostra paziente Mary Poppins.
Introduzione
Prima di entrare nel vivo della discussione riguardante la patologia della nostra paziente Mary Poppins quella che dai capitoli precedenti sembra di tipo neuromotria ed in particolare un 'Spasmo emimasticatorio' dovremmo focalizzare alcuni punti determinare il processo di decriptazione del segnale.
Cominciamo con il dire che non è tanto complesso fare diagnosi di 'Spasmo emimasticatorio' ma lo è fare diagnosi differenziale tra 'Spasmo emifacciale' e la natura della malattia per indirizzare la terapia.
Dovremmo, innanzitutto, considerare i disturbi del movimento indotti che possono essere definiti come movimenti involontari o anormali innescati da traumi ai nervi o alle radici craniche o periferici.[1] Da ciò è contestuale considerare i movimenti involontari tra cui gli spasmi, anche patologie del Sistema Nervoso Centrale oltre quello periferico. In uno studio di Seung Hwan Lee et al.[2] sono stati inclusi due schwannomi vestibolari, cinque meningiomi e due tumori epidermoidi. Lo spasmo emifacciale si è verificato sullo stesso lato della lesione in otto pazienti mentre si è verificato sul lato opposto della lesione solo in un paziente. Per quanto riguarda la patogenesi degli spasmi emifacciali, in sei pazienti sono stati trovati coinvolti i vasi, in un paziente il tumore aveva coinvolto il rivestimento del nervo facciale, compressione del tumore ipervascolare del nervo facciale senza danneggiamento dei vasi in un paziente e un enorme tumore che comprimeva il tronco cerebrale con coinvolgimento, quindi, del nervo facciale controlaterale in un paziente. Lo spasmo emifacciale è stato risolto in sette pazienti, mentre in due pazienti con uno schwannoma vestibolare e un tumore epidermoide, è migliorato transitoriamente e poi si è ripresentato dopo un mese.
Si tengano, perciò, presenti le localizzazioni anche di tipo Centrale che potrebbero essere causa di spasmo facciale e/o masticatorio, per esempio, i casi di schwannoma vestibolare e tumore epidermide.
Scwannoma vestibolare e trigeminale
Lo spasmo emifacciale secondario dovuto a schwannoma vestibolare è molto raro. Lo studio di S Peker et al.[3] è stato il primo caso riportato di spasmo emifacciale responsivo alla radiochirurgia con gamma knife in un paziente con uno schwannoma vestibolare intracanalicolare. Sia la risoluzione dello spasmo che il controllo della crescita del tumore sono stati raggiunti con una singola sessione di radiochirurgia con gamma knife. Il paziente maschio di 49 anni con una storia di 6 mesi di perdita dell'udito del lato destro e spasmo emifacciale. L'esame RM ha rivelato uno schwannoma vestibolare intracanalicolare. Il paziente è stato trattato con radiochirurgia e ha ricevuto 13 Gy alla linea di isodose al 50%. È stato raggiunto il controllo della crescita del tumore e non era presente alcun cambiamento nel volume del tumore all'ultimo follow-up a 22 mesi. Lo spasmo emifacciale si è completamente risolto dopo un anno. È stato riportato che la rimozione chirurgica della lesione di massa presumibilmente causale è l'unico trattamento nello spasmo emifacciale secondario.
La risonanza magnetica è la modalità di imaging di scelta e di solito è diagnostica nel contesto clinico appropriato. La sottile sequenza assiale CISS 3D pesata in T2 è importante per una corretta valutazione del segmento cisternale del nervo. Di solito sono ipointensi in T1, iperintensi in T2 con accrescimento dopo il gadolinio. Ma non ci possiamo sorprendere se capitano casi come quello descritto da Brandon Emilio Bertot et al.[4] in cui è stato presentato un caso clinico di un ragazzo di 16 anni con una atipica incidenza di un grande schwannoma trigeminale che presentava malocclusione indolore e debolezza masticatoria unilaterale. Questo caso è il primo caso documentato, per quanto ne sappiamo, in cui uno schwannoma trigeminale ha generato una vera malocclusione con debolezza del massetere ed è il 19° caso documentato di neuropatia motoria trigeminale unilaterale di varia eziologia. Da uno studio di Ajay Agarwal[5], comunque, si evince che gli schwannomi del trigemino intracranico sono tumori rari. I pazienti di solito presentano sintomi di disfunzione del nervo trigemino, il sintomo più comune è il dolore facciale.
Sclerosi multipla e riflessi trigeminali
Dobbiamo fare un ulteriore premessa che riguarda la demielinizzazione assonale nelle sclerosi multiple. Uno studio di Joanna Kamińska et el.[6] ha dimostrato che la sclerosi multipla (SM) è una malattia infiammatoria cronica e demielinizzante di origine autoimmune. I principali agenti responsabili dello sviluppo della SM includono fattori esogeni, ambientali e genetici. La SM è caratterizzata da un danno multifocale e temporalmente sparso del Sistema Nervoso Centrale (SNC) che porta al danno assonale. Tra i decorsi clinici della SM si possono distinguere la sclerosi multipla recidivante-remittente (SMRR), la sclerosi multipla secondaria progressiva (SPSM), la sclerosi multipla primaria progressiva (SMPP) e la sclerosi multipla progressiva recidivante (RPMS). A seconda della gravità dei segni e dei sintomi, la SM può essere descritta come SM benigna o SM maligna. La diagnosi di SM si basa sui criteri diagnostici di McDonald's, che collegano la manifestazione clinica con le lesioni caratteristiche dimostrate dalla risonanza magnetica (MRI); dall'analisi del liquido cerebrospinale (CSF) e dai potenziali evocati visivi. Va sottolineato che, nonostante gli enormi progressi per quanto riguarda la SM e la disponibilità di diversi metodi diagnostici, questa malattia rappresenta ancora una sfida diagnostica. Può derivare dal fatto che la SM ha un decorso clinico diverso e manca di un unico test di sensibilità e specificità diagnostiche appropriate per una diagnosi rapida e accurata. Proprio in riferimento a quest'ultima osservazione dobbiamo far presente un altro dato significativo emerso da uno studio di S K Yates and W F Brown[7] in cui si legge che il jaw jerk del massetere è presente in tutti i soggetti di controllo ma comunemente assente nei pazienti con sclerosi multipla definita (SM). In alcuni pazienti con SM la latenza è stata prolungata. Le anomalie nel jaw jerk, tuttavia, sono meno frequenti rispetto alle risposte del blink reflex alla stimolazione del nervo sopraorbitario. Tuttavia, ci sono stati pazienti in cui i l blink reflex erano normali ma le risposte del jaw jerk anormali.
L'ultima osservazione suggerisce che il jaw jerk può essere occasionalmente utile nel rilevamento di lesioni del tronco cerebrale nella SM.
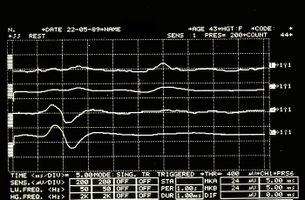
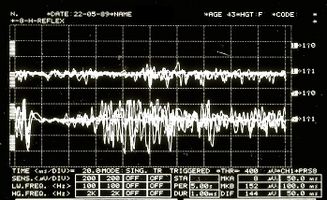
Ma a questo punto il dubbio diventa realtà: cosa dobbiamo pensare, allora, delle anomalie dei riflessi trigeminali emersi nella nostra Mary Poppins? Potremmo essere di fronte ad una forma di 'Sclerosi Multipla? Come facciamo a distinguere la localizzazione della eventuale demienizzazione se Centrale oppure Periferica? (Figura 3 e 4)
Adenoma pleomorfo
L'adenoma pleomorfo è una comune neoplasia benigna delle ghiandole salivari caratterizzata dalla proliferazione neoplastica di cellule epiteliali (duttali) insieme a componenti mioepiteliali, con potenzialità maligna. È il tipo più comune di tumore delle ghiandole salivari e il tumore più comune della ghiandola parotide. Deriva il suo nome dal Pleomorfismo architettonico (aspetto variabile) visto al microscopio ottico. È anche noto come "tumore misto, tipo ghiandola salivare", che si riferisce alla sua doppia origine da elementi epiteliali e mioepiteliali in contrasto con il suo aspetto pleomorfo.
La diagnosi dei tumori delle ghiandole salivari utilizza sia il campionamento dei tessuti che gli studi radiografici. Le procedure di campionamento dei tessuti includono l'aspirazione con ago sottile (FNA) e la biopsia con ago centrale (ago più grande rispetto all'FNA). Entrambe queste procedure possono essere eseguite in regime ambulatoriale. Le tecniche di diagnostica per immagini per i tumori delle ghiandole salivari comprendono l'ecografia, la tomografia computerizzata (TC) e la risonanza magnetica (MRI). La TC consente la visualizzazione bilaterale diretta del tumore della ghiandola salivare e fornisce informazioni sulla dimensione complessiva e sull'invasione dei tessuti. La TC è eccellente per dimostrare l'invasione ossea. La risonanza magnetica fornisce una delineazione superiore dei tessuti molli come l'invasione perineurale rispetto alla sola TC come ben descritto da Mehmet Koyuncu et al.[8]

Quest'ultima osservazione molto importante perchè non si può escludere una invasione del tumore dei tessuti nervosi nella fossa infratemporale e proprio per la complessità della malattia, riportiamo un lavoro di Rosalie A Machado et al.[9], che può essere approfondito nel sub-capitolo di Masticationpedia 'Intermittent facial spasms as the presenting sign of a recurrent pleomorphic adenoma' in cui gli autori confermano che ad oggi lo sviluppo di spasmi facciali non è stato segnalato in neoplasie parotidee. Le eziologie più comuni per lo spasmo emifacciale sono la compressione vascolare del nervo facciale omolaterale all'angolo cerebellopontino (definito primario o idiopatico) (62%), ereditario (2%), secondario alla paralisi di Bell o alla lesione del nervo facciale (17%) e imitatori di spasmi emifacciali (psicogeni, tic, distonia, mioclono, miochimia, mioritmia e spasmo emimasticatorio) (17%).
Sclerodermia
Tiago Nardi Amaral et al. [10] hanno descritto le caratteristiche cliniche, il neuroimaging e il trattamento del coinvolgimento neurologico nella sclerosi sistemica (SSc) e nella sclerodermia localizzata (LS) attraverso una revisione sistematica
Gli autori hanno effettuato una ricerca bibliografica in PubMed utilizzando i seguenti termini MeSH, sclerodermia, sclerosi sistemica, sclerodermia localizzata, sclerodermia localizzata "en coup de sabre", sindrome di Parry-Romberg, deterioramento cognitivo, memoria, convulsioni, epilessia, mal di testa, depressione, ansia, disturbi dell'umore, Centro per gli studi epidemiologici sulla depressione (CES-D), SF-36, Beck Depression Inventory (BDI), Beck Anxiety Inventory (BAI), Patient Health Questionnaire-9 (PHQ-9), neuropsichiatria, psicosi, coinvolgimento neurologico, neuropatia, nervi periferici, nervi cranici, sindrome del tunnel carpale, intrappolamento ulnare, sindrome del tunnel tarsale, mononeuropatia, polineuropatia, radicolopatia, mielopatia, sistema nervoso autonomo, sistema nervoso, elettroencefalografia (EEG), elettromiografia (EMG), risonanza magnetica (MRI) e angiografia con risonanza magnetica (MRA). I pazienti con altre malattie del tessuto connettivo responsabili del coinvolgimento del sistema nervoso sono stati esclusi dalle analisi.
Sono stati identificati un totale di 182 casi clinici/studi riguardanti la SSc e 50 riferiti alla LS. Il totale dei pazienti con SSc era 9.506, mentre erano disponibili dati su 224 pazienti con LS. Nella LS predominavano le convulsioni (41,58%) e il mal di testa (18,81%). Tuttavia, sono state fatte descrizioni di vari coinvolgimenti dei nervi cranici e di emiparesi. Il coinvolgimento del Sistema Nervoso Centrale nella SSc era caratterizzato da cefalea (23,73%), convulsioni (13,56%) e deterioramento cognitivo (8,47%). Depressione e ansia sono state osservate frequentemente (73,15% e 23,95%, rispettivamente). Miopatia (51,8%), neuropatia trigeminale (16,52%), polineuropatia sensomotoria periferica (14,25%) e sindrome del tunnel carpale (6,56%) sono stati il coinvolgimento più frequente del sistema nervoso periferico nella SSc. La neuropatia autonomica che coinvolge i sistemi cardiovascolare e gastrointestinale è stata regolarmente descritta. Il trattamento del coinvolgimento del sistema nervoso, invece, variava da caso a caso. Tuttavia, nei casi più gravi venivano solitamente prescritti corticosteroidi e ciclofosfamide.
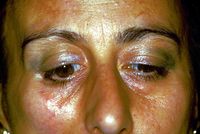
Ma questo non è tutto perchè ci sono alcune varianti della sclerodermia come la Morfea diagnosticata alla nostra povera paziente Mary Poppins che tra l'altro non ha risposto positivamente a terapia cortisonica.
Morfea
La morfea è una forma di sclerodermia che coinvolge chiazze isolate di pelle indurita sul viso, sulle mani e sui piedi o in qualsiasi altra parte del corpo, senza coinvolgimento degli organi interni. La Morfea si presenta più spesso come macule o placche di pochi centimetri di diametro, ma può anche presentarsi come bande o in lesioni guttate o noduli.[[11] La morfea è un ispessimento e indurimento della pelle e dei tessuti sottocutanei dovuto all'eccessiva deposizione di collagene. La morfea comprende condizioni specifiche che vanno da placche molto piccole che coinvolgono solo la pelle a malattie diffuse che causano deformità funzionali ed estetiche. Morphea si discrimina dalla sclerosi sistemica per la sua presunta mancanza di coinvolgimento degli organi interni.[12]
Purtroppo il cammino è ancora difficoltoso perchè la lunga serie di varianti non esclude una forma di Spasmo emimasticatorio da Morfea come ben descritto da H J Kim et al.[13] in cui si asserisce che sulla base dei risultati clinici ed elettrofisiologici trigeminali come il blink reflex, il jaw jerk ed il periodo silente masseterino, la demielinizzazione focale dei rami motori del nervo trigeminale a causa di alterazioni dei tessuti profondi è suggerita come causa di attività elettriche eccitatorie anormali con conseguente movimento masticatorio involontario e spasmo.
Quest'ultima asserzione indica un coinvolgimento delle attività elettriche eccitatorie normali ed efaptiche.
Conclusioni
Prima di discutere dei percorsi attuati per giungere alla diagnosi della nostra povera paziente Mary Poppins di 'Spasmo emimasticatorio' dovremmo anticipare che il codice criptato che si cercava di individuare come fenomeno di comunicazione riguarda la 'trasmissione efaptica', un fenomeno molto importante e complesso da evocare ma soprattutto richiede una descrizione della trasmissione elettrica tra neuroni.
La segnalazione elettrica è una caratteristica fondamentale del sistema nervoso e gli conferisce la capacità di reagire rapidamente ai cambiamenti nell'ambiente. Sebbene la comunicazione sinaptica tra le cellule nervose sia percepita principalmente come mediata chimicamente, si verificano anche interazioni sinaptiche elettriche. Due diverse strategie sono responsabili della comunicazione elettrica tra i neuroni. Uno è la conseguenza di percorsi intercellulari a bassa resistenza, detti “gap junction”, per la diffusione di correnti elettriche tra l'interno di due cellule. Il secondo avviene in assenza di contatti cellula-cellula ed è una conseguenza dei campi elettrici extracellulari generati dall'attività elettrica dei neuroni. Nel capitolo dedicato a questo fondamentale argomento si discuteranno le nozioni attuali sulla trasmissione elettrica in una prospettiva storica mettendo a confronto i contributi delle due diverse forme di comunicazione elettrica alla funzione cerebrale. ( vedi Two Forms of Electrical Transmission Between Neurons*)
- ↑ Joseph Jankovic. Peripherally induced movement disorders Neurol Clin. 2009 Aug;27(3):821-32, vii, doi: 10.1016/j.ncl.2009.04.005.
- ↑ Seung Hwan Lee 1, Bong Arm Rhee, Seok Keun Choi, Jun Seok Koh, Young Jin Lim. Cerebellopontine angle tumors causing hemifacial spasm: types, incidence, and mechanism in nine reported cases and literature review. Acta Neurochir (Wien) 2010 Nov;152(11):1901-8. doi: 10.1007/s00701-010-0796-1.Epub 2010 Sep 16.
- ↑ S Peker, K Ozduman, T Kiliç, M N Pamir. Relief of hemifacial spasm after radiosurgery for intracanalicular vestibular schwannoma. Minim Invasive Neurosurg. 2004 Aug;47(4):235-7. doi: 10.1055/s-2004-818485.
- ↑ Brandon Emilio Bertot, Melissa Lo Presti, Katie Stormes, Jeffrey S Raskin, Andrew Jea, Daniel Chelius, Sandi Lam. Trigeminal schwannoma presenting with malocclusion: A case report and review of the literature.Surg Neurol Int. 2020 Aug 8;11:230. doi: 10.25259/SNI_482_2019.eCollection 2020.
- ↑ Ajay Agarwal. Intracranial trigeminal schwannoma Ajay Agarwal. Neuroradiol J.2015 Feb;28(1):36-41. doi: 10.15274/NRJ-2014-10117.
- ↑ Joanna Kamińska, Olga M Koper, Kinga Piechal, Halina Kemona . Multiple sclerosis - etiology and diagnostic potential.Postepy Hig Med Dosw. 2017 Jun 30;71(0):551-563.doi: 10.5604/01.3001.0010.3836.
- ↑ S K Yates, W F Brown. The human jaw jerk: electrophysiologic methods to measure the latency, normal values, and changes in multiple sclerosis.Neurology. 1981 May;31(5):632-4.doi: 10.1212/wnl.31.5.632.
- ↑ Mehmet Koyuncu, Teoman Seşen, Hüseyin Akan, Ahmet A Ismailoglu, Yücel Tanyeri, Atilla Tekat, Recep Unal, Lütfi Incesu. Comparison of computed tomography and magnetic resonance imaging in the diagnosis of parotid tumors.Otolaryngol Head Neck Surg. 2003 Dec;129(6):726-32.doi: 10.1016/j.otohns.2003.07.009.
- ↑ . 2017 Feb 10;8(1):86-90. doi: 10.5306/wjco.v8.i1.86. Rosalie A Machado, Sami P Moubayed, Azita Khorsandi, Juan C Hernandez-Prera, Mark L Urken. Intermittent facial spasms as the presenting sign of a recurrent pleomorphic adenoma. World J Clin Oncol. 2017 Feb 10;8(1):86-90. doi: 10.5306/wjco.v8.i1.86.
- ↑ Tiago Nardi Amaral, Fernando Augusto Peres, Aline Tamires Lapa, João Francisco Marques-Neto, Simone Appenzeller. Neurologic involvement in scleroderma: a systematic review Semin Arthritis Rheum. 2013 Dec;43(3):335-47. doi: 10.1016/ j.semarthrit. 2013.05.002. Epub 2013 Jul 1.
- ↑ James, William; Berger, Timothy; Elston, Dirk (2005). Andrews' Diseases of the Skin: Clinical Dermatology. (10th ed.). Saunders. Page 171. ISBN 0-7216-2921-0.
- ↑ James, William; Berger, Timothy; Elston, Dirk (2005). Andrews' Diseases of the Skin: Clinical Dermatology. (10th ed.). Saunders. Page 171. ISBN 0-7216-2921-0.
- ↑ H J Kim, B S Jeon, K W Lee. Hemimasticatory spasm associated with localized scleroderma and facial hemiatrophy.Arch Neurol. 2000 Apr;57(4):576-80. doi: 10.1001/archneur.57.4.576.